Wenn das Gehirn vermüllt
Das Gehirn ist ein umsatzstarkes Organ. Für den Abtransport von Abfallprodukten aus dem Stoffwechsel, verfügt es über ein Kanalnetz, das glymphatische System. Doch das funktioniert im Alter und bei neurodegenerativen Krankheiten schlechter.
Wissenschaftliche Betreuung: Prof. Dr. Petra Wahle
Veröffentlicht: 06.11.2024
- Das Gehirn besitzt ein eigenständiges Entsorgungssystem, das glymphatische System, das sich entlang der Blutgefäße erstreckt.
- Die Müllabfuhr im Kopf arbeitet den bisherigen Daten zufolge vorwiegend in der Nacht.
- Schlafmangel führt zu einer Anreicherung fehlgebauter Proteine im Gehirn.
- Verschiedene neurodegenerative Erkrankungen von Demenzen bis zur Parkinson-Krankheit könnten mit einem gestörten glympathischen System verknüpft sein.
- Eine gestörte Entsorgung im Gehirn könnte die Auswirkungen eines Schlaganfalls oder Schädel-Hirn-Traumas beeinflussen.
- Allerdings arbeitet das Entsorgungssystem nicht isoliert, sondern im Zusammenspiel mit dem lymphatischen System, das alle übrigen Organe und Gewebe reinigt.
Gut abgeschirmt vom übrigen Körper, schwimmt das Gehirn im Nervenwasser unter der Schädeldecke. Die Blut-Hirnschranke verhindert, dass gefährliche Erreger und Gifte bis in das sensible Organ vordringen und es attackieren. Über Jahrzehnte glaubten Neurologen und Neurologinnen, dass das Hirn, autark wie es wirkt, mit seinen Stoffwechselabfällen selbst zu Rande kommt. Schließlich hat es mit den Gliazellen auch ein eigenes Immunsystem.
Doch es sind sieben Gramm Proteinmüll, die jeden Tag aus dem Oberstübchen entsorgt werden müssen. Hochgerechnet wären das pro Jahr stramme zweieinhalb Kilogramm. Nur wie gelangen die aus dem Gehirn wieder heraus. Und was, wenn nicht?
Die übrigen Organe des Menschen sind von einem Lymphsystem durchzogen, das Flüssigkeit aus dem Gewebe abtransportiert, und so den Wasserhaushalt reguliert und beispielsweise Ödeme verhindert. In den Lymphgefäßen fließen zwei bis fünf Liter klare, hellgelbe bis milchige Flüssigkeit, die mit dem überschüssigen Gewebswasser auch Schadstoffe und Krankheitserreger aus den Räumen zwischen den Zellen spülen und zu den Lymphknoten und in die Blutbahn abtransportieren. Wer sich beispielsweise tätowieren lässt, hat kurz darauf farbige Lymphknoten, da ein Teil der unter die Haut injizierten Substanzen dorthin verfrachtet wird. Die Lymphflüssigkeit fließt anders als das Blut nicht im Kreislauf. Sie wird vielmehr über Nieren und Leber ausgeschieden.
Ein eigenes Entsorgungssystem für das Gehirn
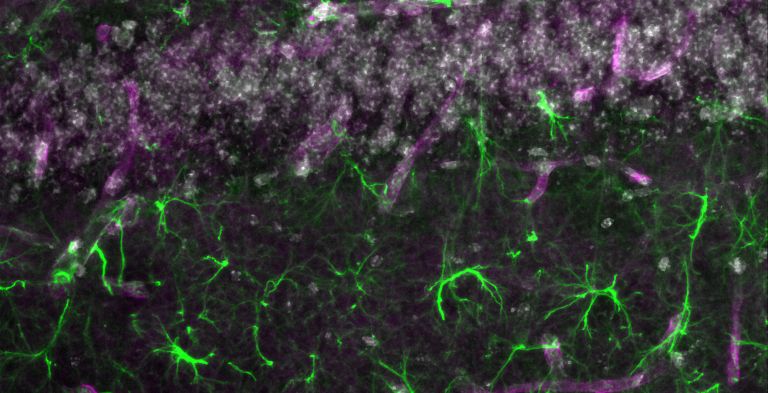
Wie aber schafft es das Gehirn seine Abfallprodukte aus dem Zellstoffwechsel ganz ohne Lymphe effizient loszuwerden? Das fragten sich Forschende in der Vergangenheit immer wieder – so auch die dänische Neurobiologin Maiken Nedergaard von der Universität Rochester in New York. Um dem Rätsel auf die Spur zu kommen, injizierte sie eine fluoreszierende Markierungssubstanz in das Nervenwasser von lebenden Mäusen. Mithilfe eines Multiphotonenmikroskops beobachtete sie, wie sich der Tracer im Liquor und im Gehirn bewegte. Sie staunte: Der Farbstoff im Nervenwasser stieg über den Rückenmarkskanal in Richtung des Hirnstamms auf und gelangte über den Flüssigkeitsraum zwischen Schädeldecke und Gehirn, den so genannten Subarachnoidalraum, ins Gehirn. Neben den Blutgefäßen erstreckt sich im Hirn ein verzweigtes, bis dahin unbekanntes Kanalsystem, das meist parallel zu den angrenzenden Blutbahnen verläuft. Später verschwand die fluoreszierende Substanz wieder über Kanäle, die entlang der Venen in Richtung Rumpf führten.
Die Wasserkanäle flankieren die Blutgefäße und sind zum Hirngewebe hin mit Astrozyten bedeckt. Astrozyten sind sternförmig verzweigte Nervenzellen. Sie tragen im Gehirn an ihren Ausläufern sogenannte Endfüße und an diesen sitzen, wie Nedergaard bemerkte, zahlreiche wasserdurchlässige Poren. Diese bestehen aus dem Protein Aquaporin-4. Die Neurobiologin schloss aus ihren Befunden: Die Poren ermöglichen das Abzweigen von Nervenwasser aus dem Kanal, das dann in die Räume zwischen den Hirnzellen fließt und diese fortlaufend umspült. Dabei nimmt das Nervenwasser Abfallstoffe auf.
Da das System dem Lymphsystem gleichkommt, taufte Nedergaard es in ihrer Veröffentlichung 2012 „glymphatisches System“. Sie spielte damit einerseits auf das bekannte Entsorgungssystem an, flocht andererseits den Begriff „Glia“ ein – denn zu diesem Zelltyp gehören die Astrozyten.
Astrozyt
Astrozyt/-/astrocyte, astroglia
Astrozyten sind die größten unter den Gliazellen. Zu ihren Aufgaben gehören z.B. die Immunabwehr (auch Blut-Hirn-Schranke) oder die Wiederaufnahme ausgeschütteter Neurotransmitter (Botenstoffen im Gehirn).
Nächtliche Gehirnwäsche
Kurz darauf beobachtete Nedergaard – ebenfalls an Mäusen, dass das glymphatische System vor allem in der Nacht aktiv ist. Sie sah zu, wie die Hirnzellen während des Schlafs schrumpften und somit der wasserdurchspülte Zellzwischenraum zunahm – gar um 60 Prozent. Tiefere Hirnregionen würden nur nachts gereinigt, postulierte die Neurobiologin daraufhin. Und als sie das Protein Beta-Amyloid – Bestandteil der Ablagerungen im Gehirn bei der Alzheimer‘schen Erkrankung – in das Nervenwasser der Mäuse zufügte, erreichte es nachts rascher das Hirngewebe. Sie rechnete im Fachblatt Science 2013 anlässlich ihrer Experimente aus, dass der Einstrom des Nervenwassers im Schlaf um 95 Prozent zunahm. Nedergaard schließt daraus, dass die „Gehirnwäsche“ nachts auf Hochtouren arbeitet.
Damit wirft sie eine ganz neue mögliche Erklärung für neurodegenerative Erkrankungen wie Demenzen und die Parkinsonsche Erkrankung in den Raum: Vermutete man bislang, dass Beta-Amyloid und andere fehlgefaltete sowie hyperphosphorylierte Proteine im Gehirn selbst abgebaut würden, bringt Nedergaard nun deren Abtransport durch das glymphatishe System ins Spiel. Funktioniert etwa die Entsorgung der schädlichen Proteine bei neurodegenerativen Leiden nicht mehr richtig? Vermüllt das Gehirn und gehen die Nervenzellen dadurch unter?
Die Hinweise darauf sind inzwischen mannigfaltig. Viele der Beobachtungen kommen von Experimenten an Mäusen: so etwa, dass sich schädliche Proteine wie Beta-Amyloide und Tau bei Demenzen und das für die Parkinson‘sche charakteristische alpha-Synuclein im Gehirn ansammeln, wenn das glymphatische System nicht richtig funktioniert. Das passiert beispielsweise, wenn die Aquporin-4-Kanäle über eine genetische Veränderung in Mäusen blockiert werden. Nedergaards Forschungen zufolge, bricht der Einstrom an Nervenwasser in das Gehirn um 70 Prozent ein. Tatsächlich sind bei vielen neurologischen Leiden, angefangen bei Demenzen über Migräne und Schädel-Hirntraumata, das glymphatische System und im Speziellen die Aquaporin-4-Kanäle verändert.
Dem Entsorgungssystem des Hirns bei der Arbeit zuschauen
„Die größte Einschränkung ist im Moment, dass wir das glymphatische System am Menschen nur indirekt beobachten können“, bedauert Katerina Deike-Hoffmann, Neuroradiologin an der Universitätsklinik Bonn. „Unser Goldstandard ist eine Methode, die so invasiv ist, dass sie bisher nur die Arbeitsgruppe um den Radiologen Geir Ringstad und den Neurochirurgen Per Eide am Universitätskrankenhaus in Oslo praktiziert.“ Sie spritzen Freiwilligen das gadoliniumhaltige MRT-Kontrastmittel Gadubutrol auf Höhe der Lendenwirbelsäule in den Liquor. Dabei handelt es sich um eine sogenannte off-Label-Anwendung: Die Arznei ist für diesen Einsatz nicht zugelassen.
Zunächst wagten beide Forscher ihre Experimente daher nur an Gesunden und ergründeten, was guter Schlaf bewirkt. Sieben Teilnehmende ließen die Forscher nach der Markierung ihres Nervenwassers die Nacht über aufbleiben. Siebzehn andere gingen wie gewohnt zuhause zu Bett. Der aufsehenerregende Befund brachte beiden 2021 eine Publikation im Journal Brain ein: Das Kontrastmittel hing bei den Personen mit Schlafentzug im Gehirn fest, wohingegen es aus dem Kopf der übrigen Probanden rascher verschwand. Besonders im cerebralen Cortex, der Region für Denken, Planen und Handeln, aber auch im Gefühlszentrum, dem limbischen System, und der weißen Substanz (LINK) zeigte sich die unterschiedlich starke Ansammlung von Abfallprodukten im Gehirn in beiden Gruppen. Und obwohl alle Probanden anschließend eine Nacht mit normalem Schlaf bekamen, konnte das Entsorgungssystem bei den Übermüdeten den Rückstand nicht mehr aufholen. Die Experimente belegen das erste Mal am Menschen, dass die Reinigung des Gehirns im Schlaf geschieht, hält Eide fest. Und, dass verpasster Schlaf nicht nachgeholt werden kann.
Dazu passend demonstrierte die Forschungsgruppe um die Neurobiologin Nora Volkow vom National Institute of Health in Bethesda schon 2018 an 20 gesunden Probanden, dass eine Nacht ohne Schlaf die Konzentration an beta-Amyloid in bestimmten Regionen ihres Gehirns erhöht. Betroffen war der rechte Hippocampus und der Thalamus, der eine wichtige Rolle bei der Verarbeitung von Sinneseindrücken spielt. Der Nachweis von mehr Proteinmüll im Gehirn bei Schlafmangel passt gut zu verschiedenen Längsschnittstudien, die darlegen, dass jene Menschen, die schlecht schlafen, ein erhöhtes Risiko haben, nachfolgend an einer Demenz zu erkranken. Nachts herumzugeistern ist damit wahrscheinlich nicht nur eine Folge der Krankheit, sondern befeuert sie auch.
Empfohlene Artikel
Gestörtes glymphatisches System bei verschiedenen Krankheiten
Auch bei vielen Hirnleiden und mitunter lebensbedrohlichen Hirnverletzungen spielt das glymphatische System der neueren Forschung zufolge eine Rolle. Beim Normaldruckhydrozephalus, auch Altershirndruck genannt, dehnen sich beispielsweise die Zwischenräume mit Nervenwasser im Gehirn erheblich aus. Es sammelt sich dadurch Flüssigkeit im Kopf, ohne dass der Hirndruck durchgängig ansteigt. Das Hirngewebe leidet allerdings und die Symptome der Erkrankung ähneln einer beginnenden Demenz. Biopsien betroffener Patienten förderten einen Mangel an Aquaporin-4-Kanälen zutage. Das könnte erklären, weshalb es zum Wasserstau im Kopf kommt.
Wie sehr das glymphatische System in Mitleidenschaft gezogen wird, könnte auch den Verlauf eines Schädel-Hirntraumas und eines Schlaganfalls mitbestimmen, besagen andere Studien. Mausexperimente offenbarten, dass der Einstrom an Nervenwasser nach einem Verschluss einer Hirnarterie, also einem simulierten Schlaganfall, einbrach. Als sich die Arterie wieder spontan öffnete, normalisierte sich der Fluss des Liquors.
Forschende dNeurowissenschaften wissen mittlerweile zudem, dass ein wichtiger Teil der Spätfolgen eines Schlaganfalls durch die nachgelagerte Entzündung und das häufig auftretende Ödem beeinflusst wird. Nedergaard zufolge rührt das Ödem unmittelbar vom glympathischen System her. Kurz nach dem Schlaganfall verdoppelte sich in ihren Mausexperimenten der Einstrom an Nervenwasser und der Raum zwischen den Hirnzellen dehnte sich aus. Eine zusammenbrechende Entsorgung des Gehirns nach dem Hirninfarkt könnte demnach eine stärkere körperliche und geistige Behinderung nach sich ziehen.
Die Müllabfuhr des Hirns arbeitet nicht für sich allein
Mit dem Alter funktioniert die Entsorgung im Gehirn zunehmend schlechter. Darauf wies die Pionierin Nedergaard schon 2014 hin, als ihr auffiel, dass bis zu 20 Monate alte Mäuse ins Gehirn injiziertes Beta-Amyloid schlechter beseitigen können als junge Artgenossen.
Jüngst gelang es einem koreanisch-amerikanisches Team, den nachlassenden Ausstrom an Nervenwasser bei Mäusen auf das erschlaffende Lymphsystem im Nasen-Rachenraum zurückzuführen. Damit weisen sie erstmals in aller Deutlichkeit auf eine Brücke zwischen dem altbekannten Lymphsystem und dem neu entdeckten glymphatischen System hin.
Dieses Zusammenspiel ist wichtig: „Das glymphatische System ist mit dem altbekannten Lymphsystem verschränkt. Es kann nicht isoliert betrachtet werden“, hebt der schwedische Radiologe Geir Ringstad hervor.
Als Beleg zieht er eine Studie heran, deren Ergebnisse mit großen Erwartungen verknüpft war: Ringstads Forschungsgruppe verfolgte 2022 als erste weltweit, wie sich die Reinigung des Gehirns bei Menschen mit Demenz vollzieht. 106 Erkrankten spritzte er Gadubutrol ins Nervenwasser. Zugleich verfolgte er den Gehalt verschiedener krankheitsassoziierter Proteine im Blut der Patienten. Es hätte so einfach ausgehen können: Besseres Entsorgungssystem im Kopf, weniger Müll im Blut. Doch das Bild, das sich Ringstad zeigte, ist viel komplizierter: Der Gehalt einiger Abfallproteine wie Tau und eines weiteren Eiweißes, das Neurodegeneration anzeigt, die sogenannte leichte Kette des Neurofilament-Proteins, nahmen mit der verminderten Reinigung des Gehirns im Blutplasma zwar zu. Aber die Leistung des glymphatischen Systems war nicht allein ausschlaggebend. Notwendig war auch der Austausch zwischen dem Liquor und dem Blut. Und: Entgegen den Erwartungen war der beta-Amyloidgehalt im Gehirn der Betroffenen schlicht nicht mit der Hirnreinigungsleistung korreliert. Die Werte standen in keinem erkennbaren Zusammenhang. Die Autoren sind sich einig: „Es sind weitere Nachforschungen, vor allem am Menschen, nicht an der Maus erforderlich, um zu verstehen, wie das glymphatische System wirklich funktioniert und wie es mit dem Lymphsystem interagiert.“ Davon abhängig, so die Hoffnung, könnten sich dann auch neue Therapieansätze für neurologische Erkrankungen ergeben.
Zum Weiterlesen
- Nedergaard, M. et al: A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid β , Science Translational Medicine, 2012, 4, 147 ( zum Abstract )
- Nedergaard, M.: Garbage Truck of the Brain, Science, 2013, 340, 6140, 1529-1530 ( zum Volltext ).
- Nedergaard, M. et al: Sleep Drives Metabolite Clearance from the Adult Brain. Science, 2013, 342, 6156, 373-377 ( zum Volltext ).
- Eide, P. K. et al: Sleep deprivation impairs molecular clearance from the human brain, 2021, 144, 3, 863-874 ( zum Abstract )
- Volkow, N. et al: β -Amyloid accumulation in the human brain after one night of sleep deprivation, PNAS, 2018, 115, 17, 4483–4488 ( zum Volltext )
- Peng, S. et al: Aquaporin-4 in glymphatic system, and its implication for central nervous
- system disorders, Neurobiology of Disease, 2023, 179, 106035, ( zum Volltext )
- Nedergaard, M. et al: Impairment of paravascular clearance pathways in the aging brain, Annals of Neurology, 2014, 76, 6, 845-61 ( zum Abstract )
- Nedergaard, M. et al: Cerebrospinal fluid influx drives acute ischemic tissue swelling. Science, 2020, 13, 367, 6483, ( zum Volltext )
- Yoon, J.-H. et al: Nasopharyngeal lymphatic plexus is a hub for cerebrospinal fluid drainage, Nature, 2024, 625, 768–777 ( zum Volltext ).
- Eide, P. K. : Neurosurgery and the glymphatic system. Acta Neurologica, 2024, 166, 274, ( zum Volltext )
- Eide, P. K.: Plasma neurodegeneration biomarker concentrations associate with glymphatic and meningeal lymphatic measures in neurological disorders, Nature Communications, 14, 2084, ( zum Volltext )